Beckmannův přesmyk
Beckmannův přesmyk, je přesmyk oximu na substituovaný karboxamid.[1][2] Lze jej provést i u halogeniminů a u nitronů. Z cyklických oximů a halogeniminů se tímto druhem přesmyku vytváří laktamy.
Beckmannovy přesmyky bývají často katalyzovány kyselinami, dají se ale použít i jiné katalyzátory, jako například tosylchlorid, chlorid thionylu, chlorid fosforečný, oxid fosforečný, triethylamin, hydroxid sodný a trimethylsilyljodid.[3][2][4]
Podobnou reakcí, často probíhající vedle přesmyků, je Beckmannova fragmentace. V závislosti na katalyzátoru, rozpouštědle a dalších podmínkách může převládat jedna i druhá reakce, někdy se vytváří téměř výhradně jediný produkt. U ketoximů a N-chlorovaných či N-fluorovaných iminů probíhá stereospecificky, přičemž je přesunující se skupina v antiperiplanární poloze vůči odstupující skupině na dusíku. Za určitých podmínek se může geometrie oximu racemizovat, čož vede k vytváření obou regioizomerů. Přesmyky aldoximů probíhají stereospecificky v plynné fázi, v roztocích se stereospecificita neobjevuje. Přesmyky aldoximů na primární amidy lze provést několika způsoby; často je však doprovází fragmentace. Nestereospecificky probíhají také přesmyky nitronů; vzniklý regioizomer mívá dusík substituovaný skupinou nejnáchylnější k přesunu.

Typickým Beckmannovým přesmykem je přeměna cyklohexanonu na kaprolaktam procházející přes oxim.[5] Vzniklý kaprolaktam se používá na výrobu nylonu 6.[6]
Jako Beckmannův roztok se označuje směs kyseliny octové, kyseliny chlorovodíkové a acetanhydridu, používaná u této reakce jako katalyzátor; lze ale použít i jiné látky, jako jsou kyselina sírová, polyfosforečné kyseliny a kyselina fluorovodíková. V průmyslu se nejvíce využívá kyselina sírová, která neutralizací amoniakem vytváří síran amonný, používaný jako hnojivo.
Mechanismus
[editovat | editovat zdroj]Nejčastější mechanismus Beckmannova přesmyku spočívá v přesunu alkylové skupiny antiperiplanárně vůči odstupující skupině za vzniku nitriliového iontu. Následuje solvolýza, která vytváří karboximidát, a tautomerizace na amid:[7]
Tento nitriliový ion bývá zachytáván dalšími nukleofily, jako odstupující skupiny na oximu.[3]
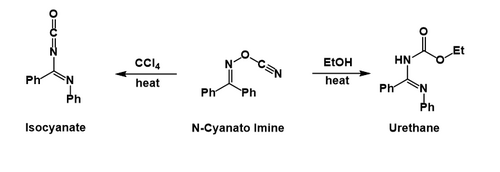
Po přesunu fenylové skupiny se odštěpí kyanát, který následně atakuje nitrilium. Je-li použit tetrachlormethan, tak lze vzniklý isokyanát izolovat, v ethanolu to ale nelze, protože se jeho solvolýzou vytváří karbamát.
Pomocí výpočetní studie byl nalezen mechanismus zohledňující vliv molekul rozpouštědla a substituentů.[8] Přesmyku molekuly acetonoximu v Beckmannově roztoku se účastnily tři molekuly kyseliny octové a jeden proton (jako hydroniový kation). V přechodném stavu, ze kterého se vytvářel iminiový ion (σ-komplex), se přesunula methylová skupina za odštěpení hydroxylu; kyslíkový atom v hydroxylu byl přitom stabilizován trojicí molekul kyseliny octové. V následujícím kroku byl elektrofilní uhlík nitriliového iontu atakován molekulou vody a proton se navázal zpět na kyselinu octovou; v přechodném stavu vedoucím k imidátu je kyslík v molekule vody spojen se čtyřmi dalšími atomy. Ve třetím kroku dojde k izomerizaci vedoucí k protonaci atomu dusíku a vytvoření amidu.
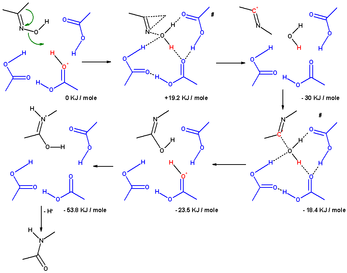
Při výpočtu zahrnujícím hydroniový ion a 6 molekul vody vycházel stejný výsledek, ale když byl přesunující se skupinou fenyl, tak se jako hlavní meziprodukt tvořil tříčlenný π-komplex. Tento π-komplex se u H3O+(H2O)6 nevyskytoval.
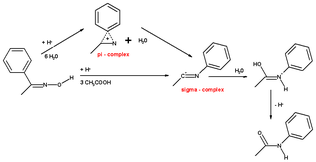
U cyklohexanonoximu se, v důsledku snížení kruhového napětí, objevuje třetí mechanismus, při němž vzniká přímo protonovaný kaprolaktam v jediném soustředěném kroku bez tvorby π- nebo σ-komplexu.
Beckmannova reakce s použitím kyanurylchloridu
[editovat | editovat zdroj]Beckmannovy reakce lze katalyzovat kyanurylchloridem s chloridem zinečnatým; takto se například převádí cyklododekanon na příslušný laktam, používaný při výrobě nylonu 12.[9][10]
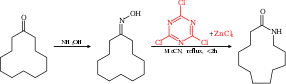
V katalytickém cyklu této reakce nejprve kyanurylchlorid nukleofilní aromatickou substitucí aktivuje hydroxyl. Následně se utvoří Meisenheimerův komplex, který je nakonec přeměněn na výsledný produkt.

Beckmannova fragmentace
[editovat | editovat zdroj]Společně s Beckmannovými přesmyky mnohdy probíhají i Beckmannovy fragmentace.[3] Pokud může skupina v poloze α vůči oximu stabilizovat vytvořený karbokation, tak dochází k významné míře fragmentace. Tímto způsobem vzniká nitril a karbokation, který je rychle zachycován za tvorby mnoha různých látek. Za podmínek reakce může rovněž nastat hydrolýza nitrilu na karboxylovou kyselinu. Za určitých podmínek může fragmentace nad přesmykem převládat.

Fragmentaci mohou vyvolávat kvaternární atomy uhlíku, které stabilizují karbokationty prostřednictvím hyperkonjugace. Vytvořený stabilizovaný karbokation odštěpí vodík za vzniku dvojné vazby. Fragmentaci usnadňují i kyslíkové (tvorbou ketonůú a dusíkové atomy (tvorbou iminů).

Síra může též vyvolávat fragmentaci, ale v menší míře.

Křemík může řídit fragmentaci skrz beta-křemíkový efekt.
Karbokation je v této reakci zachycován nukleofilním fluoridovým iontem z fluoridu diethylaminosiřičitého (DAST):[11]
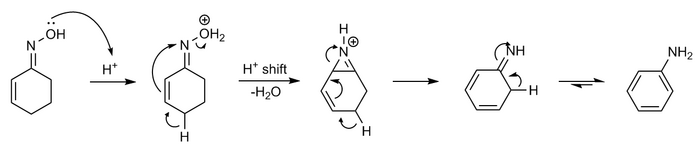
Semmlerova–Wolffova reakce
[editovat | editovat zdroj]Oxim cyklohexenonu vstupuje za přítomnosti kyselin do dehydratačně – aromatizační reakce, nazývané Semmlerova–Wolffova reakce nebo Semmlerova–Wolffova aromatizace.[12][13][14][15]
Mechanismus lze popsat takto:
Semmlerova-Wolffova reakce je zvláštním případem Beckmannova přesmyku, se zapojením sousedící skupiny.
Využití ve výrobě léčiv
[editovat | editovat zdroj]Součástí průmyslové výroby paracetamolu je přeměna methylketonu na acetanilid Beckmannovým přesmykem.[16]
Tepelný přesmyk objevující se v syntéze ketaminu je považován za Beckmannův přesmyk.[17].
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Beckmann rearrangement na anglické Wikipedii.
- ↑ Ernst Otto Beckmann. Zur Kenntniss der Isonitrosoverbindungen. Berichte der Deutschen Chemischen Gesellschaft. 1886, s. 988–993. Dostupné online. DOI 10.1002/cber.188601901222.
- ↑ a b L. G. Donaruma; W. Z. Heldt. The Beckmann rearrangement (Review). Organic Reactions. 1960, s. 1–156. Dostupné online.
- ↑ a b c R. E. Gawley. The Beckmann reactions: rearrangement, elimination-additions, fragmentations, and rearrangement-cyclizations. gallica.bnf.fr. 1886, s. 988–993. Dostupné online. DOI 10.1002/cber.188601901222.
- ↑ R. E. Gawley. The Beckmann reactions: rearrangement, elimination-additions, fragmentations, and rearrangement-cyclizations.Chybí název periodika! 1988.
- ↑ J. C. Eck; C. S. Marvel. Ε-Benzoylaminocaproic Acid. Organic Syntheses. 1939, s. 20. Dostupné v archivu pořízeném z originálu dne 2012-09-28.
- ↑ RITZ, Josef; FUCHS, Hugo; KIECZKA, Heinz. Caprolactam. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a05_031.pub2. S. a05_031.pub2. (anglicky) DOI: 10.1002/14356007.a05_031.pub2.
- ↑ Inés Lezcano-González; Mercedes Boronat; Teresa Blasco. Investigation on the Beckmann rearrangement reaction catalyzed by porous solids: MAS NMR and theoretical calculations. Solid State Nuclear Magnetic Resonance. 2009, s. 120–129. DOI 10.1016/j.ssnmr.2009.02.001. PMID 19286355.
- ↑ S. Yamabe; N. Tsuchida; S. Yamazaki. Is the Beckmann Rearrangement a Concerted or Stepwise Reaction? A Computational Study. The Journal of Organic Chemistry. 2005, s. 10638-10644. Dostupné online. DOI 10.1021/jo0508346. PMID 16355980.
- ↑ Y. Furuya; K. Ishihara; H. Yamamoto. Cyanuric Chloride as a Mild and Active Beckmann Rearrangement Catalyst. Journal of the American Chemical Society. 2005, s. 11240-11241. Dostupné online. DOI 10.1021/ja053441x. PMID 16089442.
- ↑ Douglass F. Taber; Patrick J. Straney. The Synthesis of Laurolactam from Cyclododecanone via a Beckmann Rearrangement. Journal of Chemical Education. 2010, s. 1392. DOI 10.1021/ed100599q. Bibcode 2010JChEd..87.1392T.
- ↑ Masayuki Kirihara; Kanako Niimi; Takefumi Momose. Fluorinative cleavage of cyclic ketoximes with diethylaminosulfur trifluoride: an efficient synthesis of fluorinated carbonitriles. Chemical Communications. 1997, s. 599–600. DOI 10.1039/a607749h.
- ↑ W. Semmler, Chemische Berichte 25, 3352 (1892)
- ↑ L. Wolff, Amp. 322, 351 (1902)
- ↑ Name reactions and reagents in organic synthesis, Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro
- ↑ Beckmann Rearrangements. An Investigation of Special Cases E. C. Horning, V. L. Stromberg, H. A. Lloyd, Journal of the American Chemical Society, 1952, 74 (20), pp 5153–5155 DOI:10.1021/ja01140a048
- ↑ Production of acetaminophen. Espacenet [online]. [cit. 2023-03-24]. Dostupné online.
- ↑ MOGHIMI, Abolghasem; FARAJI, Shima; TAGHVAEI, Saeed. Toward the synthesis of α-methylamino-α-phenyl-cycloheptanone [online]. 2011 [cit. 2023-03-24]. Dostupné online.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Beckmannův přesmyk na Wikimedia Commons
Obrázky, zvuky či videa k tématu Beckmannův přesmyk na Wikimedia Commons - Animace Beckmannova přesmyku
- Animace Beckmannova přesmyku vytvářejícího kaprolaktam